【详析】豁免/简化BE品种批文揭密:269亿大红包?
来源:信息员 点击量:4168 时间:2017-11-21
11月11日,为落实CFDA《关于仿制药质量和疗效一致性评价工作有关事项的公告》(2017年第100号)的“对符合《人体生物等效性试验豁免指导原则》的品种,以及不适合开展人体内研究的品种,国家食品药品监督管理总局区别情况,分批公布具体品种目录”的要求,仿制药质量与疗效一致性评价办公室组织人员对289基药目录内品种进行了梳理和调研,并经CFDA仿制药质量和疗效一致性评价专家委员会审议,拟定了首批拟推荐豁免或简化生物等效性试验(BE)的品种名单,合计涉及57个产品。
根据《总局关于落实〈国务院办公厅关于开展仿制药质量和疗效一致性评价的意见〉有关事项的公告》(2016年第106号),凡2007年10月1日前批准上市的列入国家基本药物目录(2012年版)中的化学药品仿制药口服固体制剂,原则上应在2018年底前完成一致性评价的品种289个,按同年总局公布的《关于2018年底前须仿制药质量和疗效完成一致性评价品种批准文号信息》统计结果,合计17,740个批文将要在2018年年底完成一致性评价。
自2016年4月总局公开征求《人体生物等效性试验豁免指导原则》的意见到同年5月正式稿发布起,业界一直在期待《可豁免或简化人体生物等效性试验(BE)品种目录》的发布。
2017年11月首批目录终于发布征求意见稿且至12月11日结束意见征求,距离2018年年底的时间仅一年有余。本文主要对可豁免或简化的已上市品种批文情况进行分析。
可豁免或简化生物等效性试验(BE)的品种名单,将品种分为“豁免BE品种”和“简化BE品种”两类。
三类可豁免BE品种
涉及批文4167个,预计启动批文925个、研发费用28亿元
可豁免BE品种共44个,涉及批文4167个。其中,拟处理办法“采用药学方法评价一致性,可豁免BE”的有20个;“采用药学方法评价一致性,企业自证BCS(生物药剂学分类系统)1或3类,根据《人体生物等效性豁免指导原则》提交溶解度、渗透性、溶出度等相关研究资料”的有20个;“采用药学方法评价一致性,采用比较PK方法评价安全性”的有4个。
“采用药学方法评价一致性,可豁免BE”的20个品种中,异烟肼片是在2018年年底前需要完成一致性评价批文数最多的产品,维生素B6片和维生素B2片紧随其后。
批文数在5个以内的产品有磷酸伯氨喹片、聚乙二醇 4000散、氯化钾颗粒、琥珀酸亚铁片、环磷酰胺片和左氧氟沙星片。按总局《关于企业开展289目录内仿制药质量和疗效一致性评价基本情况信息》,左氧氟沙星片暂无企业启动一致性评价。
先声药业有限公司蒙脱石散的一致性评价申请已被受理,是20个豁免BE品种中的首个申报品种。
表1 “采用药学方法评价一致性,可豁免BE”品种情况
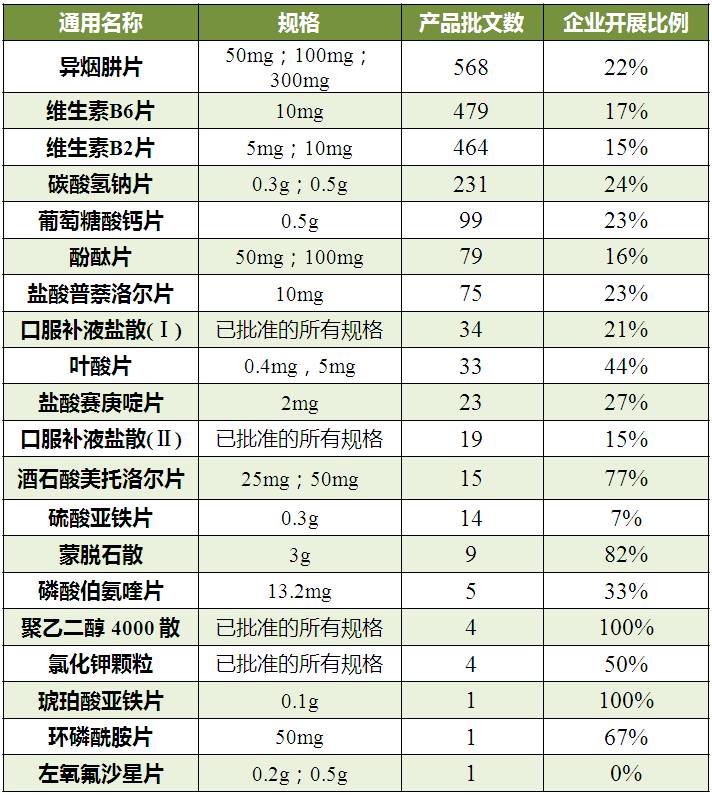
(数据来源:咸达数据V3.2)
按照《人体生物等效性试验豁免指导原则》,药品被分为四类,分别为BCS1类“高溶解性、高渗透性”,BCS2类“低溶解性、高渗透性”,BCS3类“高溶解性、低渗透性”和BCS4类“低溶解性、低渗透性”。其中BCS1类和BCS3类的药物,只要处方中的其他辅料成分不显著影响API的吸收,则不必证明该药物在体内生物利用度和生物等效的可能性,即生物等效性豁免。
BCS1类的药物要想获得生物等效性豁免,需要证明药物具有高溶解性和高渗透性,仿制药制剂和参比制剂均为快速溶出,并且制剂中不含有影响主药成分吸收速率和吸收程度的任何辅料。BCS3类的药物则需要证明药物具有高溶解性,仿制制剂和参比制剂均具有非常快速的溶出,两者处方完全相同,各组成用量相似,当放大生产和上市后变更时,制剂处方也应完全相同。
“采用药学方法评价一致性,企业自证BCS1或3类,根据《人体生物等效性豁免指导原则》提交溶解度、渗透性、溶出度等相关研究资料”的品种,共涉及1908个批文数。其中,甲硝唑片批文数最多,盐酸雷尼替丁胶囊和对乙酰氨基酚片批文数紧随其后。暂无企业启动一致性评价的产品为对乙酰氨基酚颗粒。
在《人体生物等效性试验豁免指导原则》的附录A中,曾公布一批用于说明渗透性试验适用性的推荐药物,其中阿替洛尔、雷尼替丁就属于渗透性类别“中渗透性(fa=50%—84%)”,两者在世界卫生组织发布的BCS分类(2005年)中皆为3类。
按企业开展结果,豁免BE品种预计925个批文若启动,则预计企业将要花费的研发费用高达28亿元。
表2 “采用药学方法评价一致性,企业自证BCS1或3类”豁免 BE品种情况
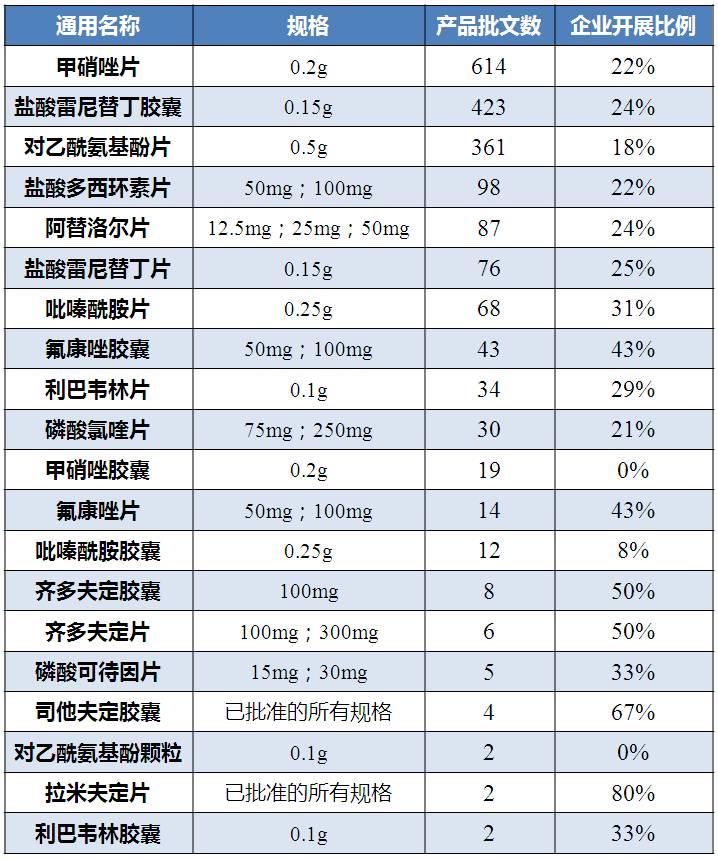
(数据来源:咸达数据V3.2)
“采用药学方法评价一致性,采用比较PK方法评价安全性”主要涉及枸橼酸铋钾和胶体果胶铋两个通用名,对应批文总数为101个。
表3 “采用药学方法评价一致性,采用比较PK方法评价安全性”豁免BE品种情况
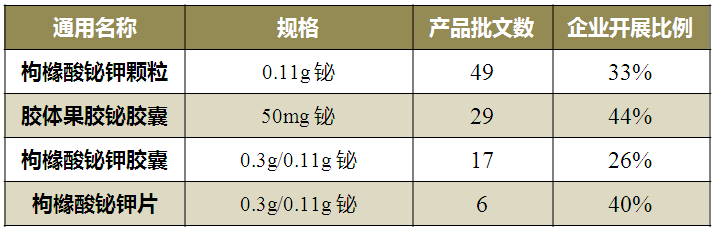
(数据来源:咸达数据V3.2)
两种简化BE品种
涉及批文共2020个,预计启动408个批文、研发费用25亿元
“简化BE品种”分为“推荐仅餐后研究”和“推荐仅空腹研究”两种拟处理办法。
“推荐仅餐后研究”仅替硝唑片0.5g规格,对应批文28个,企业开展比例65%。咸达数据V3.2发现,目前仅华润双鹤利民药业(济南)开展餐后研究。
“推荐仅空腹研究”中,复方磺胺甲噁唑片批文数最多,其次是利福平胶囊,卡托普利片排名第三。卡托普利片已有石药集团欧意药业申报一致性评价,同期启动空腹研究的有常州制药厂、山东新华制药和山东罗欣药业,但暂未申报一致性评价。
按企业开展结果,若简化BE品种408个批文启动,则研发费用预计25亿元。
表4 简化 BE品种“推荐仅空腹研究”情况
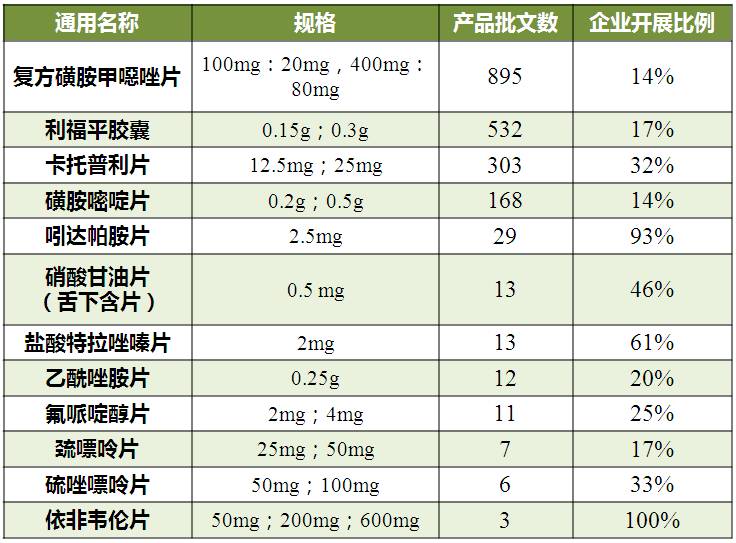
(数据来源:咸达数据V3.2)
小结<<<
豁免BE或简化BE是基于BSC分类原则作出的生物等效豁免。首批拟推荐豁免或简化BE品种名单的公布,并不代表一致性评价的标准放宽,反而体现了我国一致性评价的标准正与国际化挂钩,对治疗窗很宽的低风险品种进行合理地豁免或简化。实际上,首批名单中已受理一致性评价申请的企业早就按照BSC分类原则申请豁免和简化。
若以所有批文都启动临床来计算,豁免BE品种对应4167个批文,若以500万元临床费用统计,预计对应豁免临床费用为208.35亿元。简化BE品种对应2020个批文,若以300万元临床费用统计,对应简化的临床费用为60.6亿元。两者合计有269亿元的红利。
按企业开展结果,若豁免BE品种预计925个批文启动,则预计企业将要花费的研发费用高达28亿元;若简化BE品种408个批文启动,则研发费用预计25亿元。本次57个品种名单涉及53亿元的研发费用,预计豁免或简化的研发费用59亿元。
市场潜力较大且批文数较少的品种豁免BE或简化BE后,原定未打算开展的已上市批文企业或未有批文的企业可能会加入竞争。
其余未进入首批名单的231品种对应的企业也可向CFDA提出豁免申请并说明理由,CFDA经论证后,决定是否同意豁免。


